 官方微信
官方微信

 官方微信
官方微信

浏览量:6442 发布时间:2022-09-06
近年来土壤酸化在全国范围内普遍发生,引起民众、政府部门和科研人员的高度关注。但不同人群对土壤酸化知识的理解还存在一定的偏差,因而本文针对土壤酸化的几个冷知识进行科普介绍。
1、土壤中的盐基阳离子不是碱
土壤中的盐基阳离子指正二价的钙和镁及正一价的钾和钠(Ca2+、Mg2+、K+、Na+),它们大部分通过静电吸引作用吸附于土壤固相表面,这也使得带负电荷的土壤表面保持电中性状态,这部分盐基阳离子称为交换性盐基阳离子。小部分盐基阳离子存在于土壤溶液中,使盐基阳离子在固/液之间保持吸附与解吸平衡。多雨条件下,土壤溶液中的盐基阳离子会随地表径流流失或沿土壤剖面向下迁移进入地下水。这一过程打破了盐基阳离子在固/液相之间的吸附-解吸平衡,原先吸附在土壤固相表面的部分交换性盐基阳离子释放到土壤溶液中,空缺的吸附位(也叫阳离子交换位)被氢离子(H+)占据,产生交换性H+,土壤发生酸化(图1)。因此,有人认为盐基阳离子是“碱”,土壤中这部分碱性物质的淋失导致了土壤酸化。这种认识是不正确的。

图1:土壤中交换性盐基阳离子淋失和交换性H+的产生过程示意图
按照广义酸碱理论(也称为路易斯(Lewis)酸碱理论),包括盐基阳离子在内的所有阳离子都是酸,只不过盐基阳离子是非常弱的酸。常见的阳离子如Al3+、Fe3+、NH4+及重金属阳离子呈明显的酸性。为了进一步理解盐基阳离子的酸碱性,我们举例来说明。氢氧化钠(NaOH)和氢氧化钾(KOH)是常见的强碱,它们溶解在水中完全离解为氢氧根(OH-)、K+和Na+。当发生酸碱中和反应时,OH-与H+结合形成H2O。如果K+和Na+是碱,那么H+应该与K+和Na+发生中和反应,那OH-干什么呢?很显然,在这2种强碱中,OH-是碱,K+和Na+是与碱配对的阳离子。盐基阳离子的英文单词是Base cations,这是导致部分人产生错误认识的原因。但这个英文词组不应该翻译为碱性阳离子,而应该理解为碱基阳离子,意思是与碱配对的阳离子。
2、土壤中的酸主要以活性铝的形态存在于固相部分
当外源H+进入土壤,如果土壤固相含碳酸盐,H+将优先与碳酸盐反应而消耗掉,土壤pH下降会很慢;但如果H+进入酸性土壤,H+将与土壤交换性盐基阳离子发生离子交换反应,释放部分交换性盐基阳离子到土壤溶液中,同时产生交换性H+。由于H+的反应活性很高,交换性H+不稳定,这部分H+的大部分会与土壤粘土矿物反应,释放土壤铝硅酸盐矿物结构中的铝,并产生交换性Al3+。交换性铝与交换性H+的总和为交换性酸,当达到反应平衡时,土壤的交换性酸主要以交换性铝存在(图2)。在有机质含量很低的强酸性矿质土壤中,交换性铝占交换性酸的比例达95%以上。因此,土壤发生酸化后土壤中的绝大部分酸以交换性铝的形态存在于土壤固相部分,仅有一小部分酸存在于土壤溶液中。前者称为土壤潜性酸度,后者称为活性酸度。
土壤酸度通常用土壤pH来表示,土壤pH一般用pH电极测定,它的数值为土壤溶液中H+活度的负对数值,因此土壤pH变化1个单位,H+活度变化10倍。土壤潜性酸度与活性酸度之间保持平衡关系,主要通过少量交换性铝的释放、溶液中Al3+的水解与H+的产生为纽带(图2)。虽然土壤pH表示土壤活性酸度,它仍可反映土壤酸性的强弱程度,但不能表示土壤酸的数量。
土壤酸化后大量酸累积在土壤固相部分,中和这部分酸比中和溶液中的活性酸所需石灰等碱性物质的数量要多得多。而且潜性酸主要以交换性铝存在,它与碱的反应速度比H+慢得多。因此,土壤酸化后其改良难度很大,保护土壤,阻控酸化是我们的重要职责。
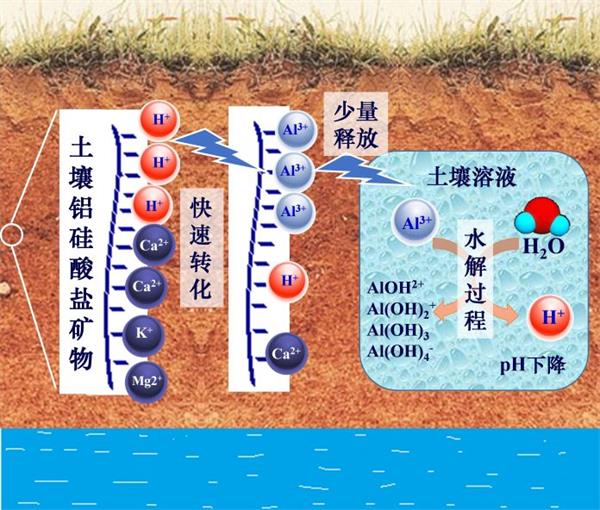
图2:交换性H+转化为交换性铝及交换性铝释放、水解和产H+的过程示意图
3、铵态氮肥即使全部被植物吸收也会酸化土壤
人为活动加速土壤酸化的致酸源主要有2个方面:酸沉降和不当的农业措施。酸沉降的影响比较容易理解,它将酸直接输入土壤中。农业措施中施用铵态氮肥是加速土壤酸化的主要原因。铵态氮肥对土壤酸化影响的大小涉及铵态氮的硝化反应、作物对氮素的吸收以及氮的淋溶损失等几个方面。先以硝酸铵(NH4NO3)为例说明作物吸收的影响,如果施入土壤中的NH4NO3全部被作物吸收利用,它对土壤酸化没有影响。但大多数植物对阳离子的吸收量多于阴离子,如果植物吸收的铵离子(NH4+)多于硝酸根(NO3-),植物为了维持体内的电荷平衡,会通过根系释放H+到土壤中,酸化土壤。由于硝酸铵是受管制的化学品,目前常用的氮肥是尿素、硫酸铵和氯化铵。尿素在土壤中还涉及水解反应,本文不作讨论。由于作物对硫酸根和氯离子的吸收量低于硝酸根,因此单从作物吸收角度,这2种氮肥施用后对土壤的酸化作用也大于硝酸铵。
事实上铵态氮肥施入土壤后会很快发生硝化反应,其方程式为:NH4+ + 2O2 = 2H+ + NO3- + H2O。可以看出,1份铵离子经硝化反应产生1份硝酸根和2份H+,如果硝化产生的硝酸根全部被植物吸收,植物根系会释放等比例的OH-,中和掉一半的H+,另一半H+留在土壤中。但如果硝化产生的硝酸根随降雨淋失掉,那么2份H+均留在土壤中,酸化土壤。正如上文所说,H+的反应活性高,一旦产生会很快与土壤发生反应,它随降雨的淋失很少。而硝酸根为阴离子,带负电荷的土壤表面对其的静电排斥作用使它很容易从土壤中淋失。
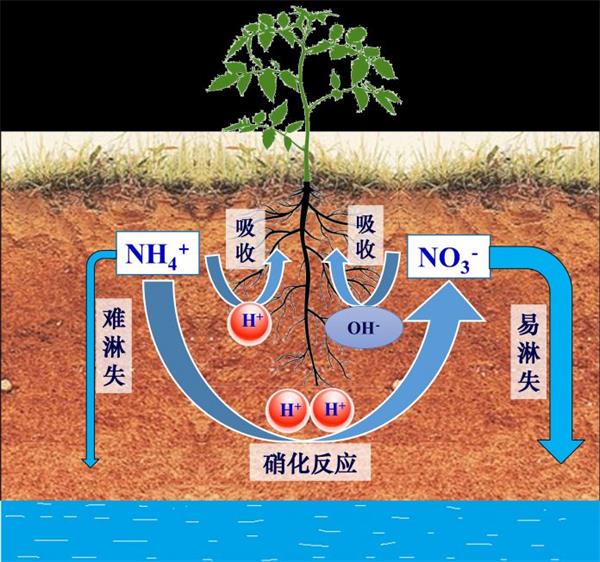
图3:植物对铵态氮和硝态氮的吸收、硝化反应、硝态氮淋失与土壤酸化关系示意图
根据上述分析,施用铵态氮肥将不可避免地引起土壤酸化,但采取合理的管理措施,适当降低化学氮肥的施用量,提高氮肥的利用率,减少氮肥的淋溶损失,可以将其对土壤酸化的影响降至最小程度。
土壤酸化会对农林业生产和生态环境产生危害,但这种危害只有在酸化达到一定程度时才会表现出来。一般,将土壤pH维持在5.5以上的弱酸性条件不仅不会对大多数植物的生长产生不利影响,还可保持土壤中的微量营养元素(金属)具有较高的活性和生物有效性。因此,通过合适的施肥和田间管理措施,将土壤的酸碱度维持在合适的水平对农业可持续发展和生态环境保护都至关重要。